香烟肺腺癌细胞致癌表型
肺癌是全球癌症死亡的主要原因,吸烟是其主要诱发因素。尽管已知卷烟中的致癌物质会导致致癌 DNA 改变,但对患者队列的分析显示,没有明确的驱动突变的异质遗传畸变。此后,非编码 RNA (ncRNA) 在肺癌发病机制中的作用已得到证实。它们的失调与癌症的发生和进展有关。最近发现一种名为烟雾和癌症相关 lncRNA 1 (SCAL1) 的新型长链非编码 RNA (lncRNA) 在暴露于烟雾的腺癌肺泡上皮细胞中上调。本研究使用 A549 细胞作为模型系统表征 SCAL1 过表达和敲低的表型后果,无论是否事先接触过香烟烟雾提取物 (CSE)。通过 CSE 处理或 SCAL1 过表达增加 SCAL1 水平导致细胞迁移增加、广泛的细胞骨架重塑和对细胞凋亡的抵抗。此外,SCAL1 水平与细胞内活性氧 (ROS) 的水平呈负相关。相比之下,SCAL1 敲低显示了这些检测相反的结果。这些结果证实了 SCAL1 的致癌功能及其作为 CSE 激活的 lncRNA 的作用,该 lncRNA 介导 A549 细胞中的 ROS 解毒,从而使它们能够对烟雾诱导的毒性产生抗性并使其存活。SCAL1 敲低显示出相反的结果。这些结果证实了 SCAL1 的致癌功能及其作为 CSE 激活的 lncRNA 的作用,该 lncRNA 介导 A549 细胞中的 ROS 解毒,从而使它们对烟雾诱导的毒性产生抗性并存活下来。SCAL1 敲低显示出相反的结果。这些结果证实了 SCAL1 的致癌功能及其作为 CSE 激活的 lncRNA 的作用,该 lncRNA 介导 A549 细胞中的 ROS 解毒,从而使它们对烟雾诱导的毒性产生抗性并存活下来。
介绍
吸烟是肺肿瘤发生的第一大诱发因素1。很大一部分肺癌死亡可归因于吸烟——美国和法国约 80% 的患者、亚洲 61% 的患者和撒哈拉以南非洲 40% 的患者2。腺癌表达模式的全基因组分析揭示了吸烟者和从不吸烟者肿瘤之间基因组和转录组学的差异。一般来说,从不吸烟者身上获得的肿瘤的侵袭性比在吸烟者身上发现的要小1。
尽管吸烟被确定为肺肿瘤发生的驱动因素,但最终导致侵袭性肿瘤表型的分子机制仍不清楚。据推测,肺 DNA 长期暴露于香烟中存在的代谢活性致癌物质会导致 DNA 加合物和遗传损伤,从而可能导致致癌作用3. 尽管由烟雾引起的损伤引起的基因改变可能是肺癌的原因,但这些突变在患者队列中是异质的,并且很难确定导致疾病发作的驱动突变。此外,癌基因和肿瘤抑制基因的突变可能不是肺癌的唯一原因。近年来,包括 microRNA、lncRNA 和环状 RNA 在内的非编码 RNA 与许多癌症类型有关。在肺癌组织中,癌相关区域长非编码 RNA 5 (CARLo5) 4、分化拮抗非蛋白编码 RNA (DANCR) 5、6、INK4 基因座中的反义非编码 RNA (ANRIL) 7、lncRNA H19 8和结肠癌相关转录物 2 (CCAT2) 9被发现上调;而 BRAF 激活的非编码 RNA (BANCR) 10、母源表达基因 3 (MEG3) 11和牛磺酸上调基因 1 (TUG1) 12显示被下调。最近,Thai 及其同事的一项研究显示,吸烟者气道上皮细胞中一种 lncRNA 水平高度升高,后来被命名为烟雾和癌症相关 lncRNA 1 (SCAL1),在暴露于香烟烟雾的肺癌细胞中,这种 lncRNA 水平也上调13. 它的发现导致了几个假设,这些假设表明 SCAL1 可能将烟雾暴露的化学线索转化为具体的致癌刺激,如表观遗传变化。SCAL1 在肿瘤发生中的作用现在似乎更加普遍并扩展到其他细胞环境。它已被证明可促进透明细胞肾细胞癌14、肝细胞癌15、胃癌16、宫颈癌17和神经胶质瘤细胞18 的增殖和侵袭;甲状腺乳头状癌的增殖、侵袭、细胞周期进程和细胞存活19; 食管鳞状细胞癌通过 DNA 甲基化抑制肿瘤抑制基因的增殖、细胞存活、转移和抑制20;乳腺癌细胞中干细胞样特性的增殖和诱导21;卵巢癌的增殖和存活22;和抑制结肠直肠癌细胞的凋亡23。
SCAL1 是一种 890-bp 的 lncRNA,已被假定在烟雾诱导的损伤后启动上皮细胞的修复。在肺癌细胞中,这种 lncRNA 的表达对于对抗由顺铂和多柔比星等化疗药物诱导的 DNA 双链断裂是必要的24. SCAL1 表达受核因子红细胞 2 相关因子 2 (NRF2) 控制,NRF2 是一种转录因子,被认为是抗氧化基因的主要调节因子,通常保护细胞免受氧化应激造成的损伤。在生理条件下,NRF2 由于与 Kelch 样 ECH 相关蛋白 1 (KEAP1) 相互作用而在胞质溶胶中泛素化和降解。然而,亲电损伤产生的 ROS 会导致 KEAP1 蛋白的结构改变,这反过来又使 NRF2 逃脱降解并转移到细胞核中以激活抗氧化基因的表达。NRF2 可以结合 SCAL1 启动子中假定的核因子 - erythroid-2 (NFE2) 结合位点,从而上调其表达。而且,25 .
尽管如细胞活力测定所示,假设可以从香烟烟雾暴露的毒性作用中拯救肺癌细胞,但 SCAL1 上调的致癌作用,无论是继发于香烟烟雾还是与香烟烟雾脱钩,尚未阐明。在这项研究中,通过研究暴露于香烟烟雾提取物 (CSE) 以及 SCAL1 过表达和敲低对迁移能力、继发于广泛细胞骨架重组的侵袭性结构的形成、抗凋亡和活性氧(ROS)。
结果
SCAL1 在 CSE 处理的 A549 细胞中上调
A549 腺癌肺泡上皮细胞在 CSE-DMEM 的任意稀释度(0.01×、0.02×、0.1×、0.5×CSE 稀释度和浓缩或 1×CSE)中培养,以促进对 CSE 诱导的 SCAL1 上调的剂量依赖性研究。为了测量 SCAL1 lncRNA 的表达水平,在 48 小时的潜伏期后,从 CSE 处理的 A549 细胞中提取总 RNA。然后在暴露于不同 CSE 浓度的设置中比较 SCAL1 水平。如图1所示 a,暴露于增加的 CSE 浓度直至两倍稀释设置伴随着 SCAL1 的相对表达水平的相应增加。然而,在浓缩 CSE 设置中观察到 SCAL1 水平降低。SCAL1 表达水平与未处理设置中观察到的水平没有显着差异。
CSE 处理的 A549 细胞中的 SCAL1 表达水平。(a)SCAL1 表达水平随着香烟烟雾提取物(CSE)浓度的增加而增加,但在最高浓度的 CSE 下培养时降低。(b)当细胞暴露于 0.1 × CSE 48 小时后,在 DMEM 中恢复 24 小时时,SCAL1 水平显着低于保持在 0.1 × CSE 中的水平,但仍显着高于对照设置。提供的数据代表三个独立的试验,并表示为平均值 ± SD。*P < 0.05,**P < 0.01,***P < 0.001 和 ****P < 0.0001。
全尺寸图片为了确定将暴露于 CSE 的细胞恢复到不含 CSE 的培养基是否会影响 SCAL1 表达,最初用 0.1 × CSE 处理了两种 A549 细胞设置。48 小时后,一种设置用新鲜的 0.1×CSE 培养基补充,而另一种更换为不含 CSE 的培养基。RT-qPCR分析表明切换CSE暴露的细胞游离CSE-介质(图之后SCAL1表达下降 1 b)中指示急性曝光随后的恢复期可下调SCAL1表达。
SCAL1过表达表型对香烟烟雾暴露对A549细胞迁移率的影响
通过划痕试验研究了 SCAL1 lncRNA 对 A549 肺癌细胞迁移能力的影响。在 CSE 处理、SCAL1 过表达和 SCAL1 敲低设置中测量细胞迁移。显示转染细胞中 SCAL1 过表达和敲低的初步实验如图S1所示。
暴露于不同浓度的CSE迁移速率A549细胞表现出相似的趋势SCAL1表达的图的RT-qPCR的结果 1成一个。迁移率增加直到两倍稀释设置然后在暴露于更高的 CSE 水平时降低(图2一、二)。暴露于 CSE 浓度增加的 A549 细胞迁移能力的增加,以及 SCAL1 表达水平的伴随增加表明 lncRNA 可能介导香烟烟雾暴露的影响,至少部分地促进细胞迁移。为了确定 SCAL1 是否确实介导了 CSE 暴露的促迁移效应,至少部分地,用 0.1×CSE 处理 A549 细胞 24 小时以上调 SCAL1 表达。然后用 30 nM siSCAL1 转染细胞以抑制 SCAL1 表达。划痕损伤试验证实SCAL1在CSE暴露细胞的敲低降低显著A549细胞(图的迁移能力2 C,d)。
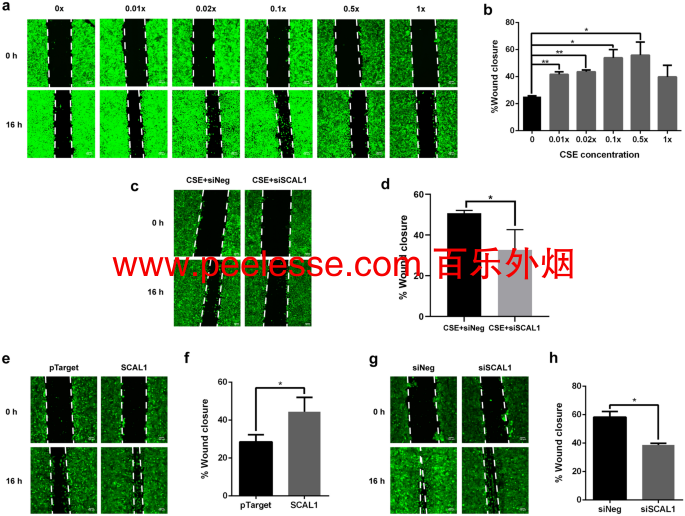
对 CSE 处理的 A549 细胞进行划痕分析以测量迁移能力。(a,b)伤口闭合率增加,直到 0.5 × 稀释设置,但在浓缩的 1 × 设置中观察到突然下降。(c,d)当 SCAL1 在暴露于 0.1 × CSE 后 24 小时被击倒时,与对照相比,16 小时后伤口闭合显着减少。( e 。 f ) SCAL1 过表达增加了伤口愈合率,而在 ( g 。 h) SCAL1 击倒。显示的图像代表一式三份完成的三个独立试验。提供的数据代表三个独立的试验,并表示为平均值 ± SD。*P < 0.05,**P < 0.01,***P < 0.001 和 ****P < 0.0001。
全尺寸图片在A549细胞中SCAL1的过表达表型模拟CSE曝光的影响,并与所述PTARGET™空载体对照(图增加迁移速率2 E,F)。SCAL1敲低,另一方面,相对于siNeg(阴性对照)的设置(图降低A549细胞的迁移能力2 G,H)。总之,这些在无 CSE 培养基中进行的实验表明,尽管 SCAL1 上调可能部分介导了 CSE 的促迁移作用,但其对细胞迁移的影响仍然可以与 CSE 的影响分离。
CSE治疗和SCAL1上调对细胞骨架重塑和侵袭性结构形成的独特和重叠影响
为了研究 CSE 暴露和 SCAL1 转录水平对 A549 细胞侵袭性表型的影响,通过鬼笔环肽染色和荧光显微镜评估处理或转染细胞的细胞骨架结构。与未处理的对照 A549 细胞相比,对 CSE 处理的细胞的细胞骨架组织的分析揭示了可变的总体形态变化。如图3所示 a,在0×和0.01×CSE下,A549细胞相对较大,具有明显的粘着斑和应力纤维。此外,作为一种上皮细胞系,由细胞间连接促进的细胞间粘附是突出的。在较高的 CSE 浓度下,观察到 A549 细胞减少与邻近细胞的相互作用。在 0.02×CSE 中,细胞骨架重组是明显的,许多细胞呈圆形,外周肌动蛋白边缘较厚,细胞核位于细胞一侧。外周肌动蛋白束是 lamellipodial 形成和运动的积极指标,也可能在迁移过程中的核变形中发挥作用26 。 27 。 28. 丝状伪足,与转移扩散有关的细细胞突起,在未处理的对照细胞中可识别,但在暴露于 0.02×CSE 的细胞中更丰富。突出的肌动蛋白结构也很突出。在 0.1× 和 0.5× CSE 中,畸形或多叶状核以及那些表现出气泡的核占优势。融合的多核细胞也更容易观察到。最后,暴露于更高浓度 CSE(0.5 倍和 1 倍)的细胞会形成更多的细胞间连接,类似于隧道纳米管 (TNT)。TNT 是薄的、基于肌动蛋白的细胞间桥梁,允许细胞器、质膜成分和细胞质分子在连接的细胞之间通过,并可能进一步促进侵袭性29 。 30 。 31. 还可以观察到具有锥形迁移前沿和突出的片状伪足的分离细胞以及多核细胞。
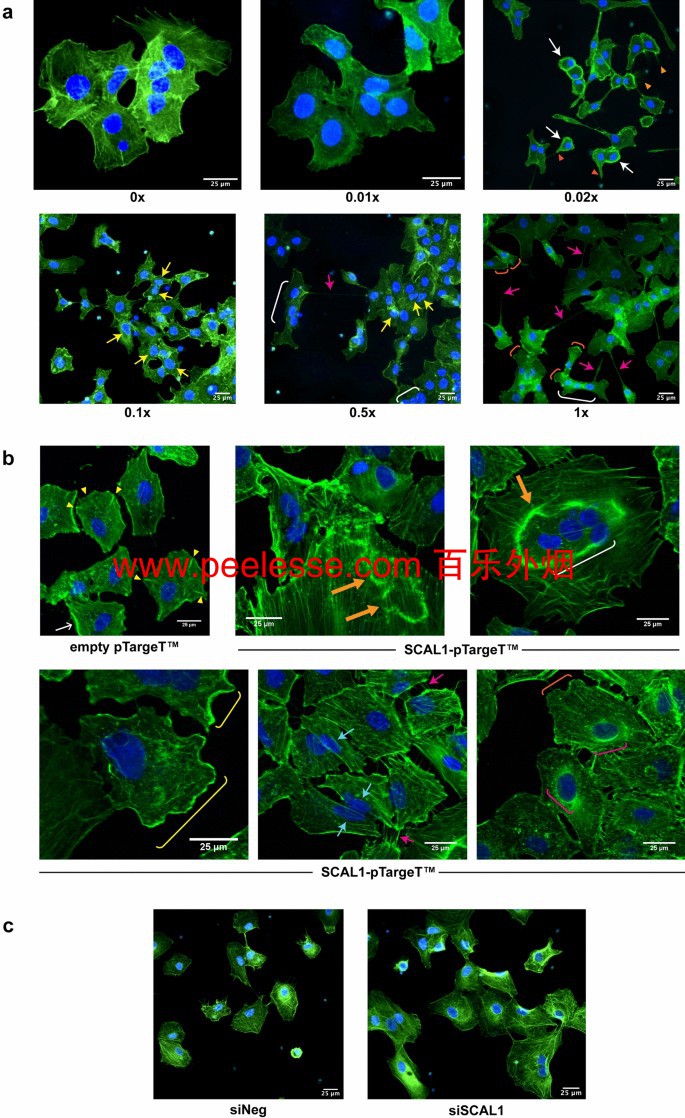
用鬼笔环肽-FITC 和 Hoechst 33342(Olympus IX3-HOS,×400,FITC:500 ms)对 CSE 处理的、SCAL1 过表达和 SCAL1 缺陷的 A549 细胞进行荧光染色。(a)暴露于不同 CSE 稀释度的 A549 细胞显示出与迁移和侵袭相关的结构的形成,例如侵袭伪足(红色箭头)、毛发状丝状伪足(橙色箭头)、厚外周肌动蛋白(白色箭头)、隧道纳米管(TNT)-像结构(紫红色箭头)、多叶细胞核(黄色箭头)、多核细胞(白色括号)和片状伪足(橙色括号)。(乙) 空载体转染的对照细胞显示出稳定的细胞骨架,具有突出的径向突起/粘连(黄色箭头)。用 SCAL1 转染的细胞显示出瞬时结构,如圆形背侧褶皱(黄色橙色粗箭头)、外周背侧褶皱(黄色括号)、拉伸核(青色箭头)和核周肌动蛋白边缘(紫红色括号)。(c)与 siNeg 对照相比,用 SCAL1-siRNA 转染的 A549 细胞彼此分离更多,并表现出更有组织的细胞骨架,具有突出的应力纤维。
全尺寸图片SCAL1的过表达诱导仅部分地与那些在观察到重叠CSE-处理的A549细胞(图细胞骨架改变 3 B)。仅用 pTargeT 空载体转染的对照细胞通常呈多边形,具有可识别的径向突起,代表能够防止迁移的稳定粘着斑。用 SCAL1 转染的细胞显示出更多的瞬时结构,可以破坏应力纤维,促进或促进细胞迁移。这些包括外周褶皱、圆形背褶皱 (CDR)、核周肌动蛋白边缘和位于外周的拉伸核。大的多核细胞也更容易观察到。
相比之下,通过 RNA 干扰降低 SCAL1 水平,导致细胞骨架结构的相对稳定。如图所示。 3 ℃,用SCAL1特异性siRNA转染的细胞显示出更有条理的肌动蛋白具有平行应力纤维和非常少的,更短的丝状伪足皮质。此外,细胞之间似乎更加粘附。原子核的形状也更规则。另一方面,siNEG 对照显示松散堆积和纵横交错的肌动蛋白丝以及更广泛的丝状伪足形成,并且更孤立。
总体而言,CSE 治疗和 SCAL1 上调对细胞骨架重组的独特和重叠影响表明,虽然 SCAL1 上调可能部分介导 CSE 的影响,但其对致癌表型的影响仍然可以与 CSE 的影响分离。
香烟烟雾和SCAL1促进A549细胞抗凋亡
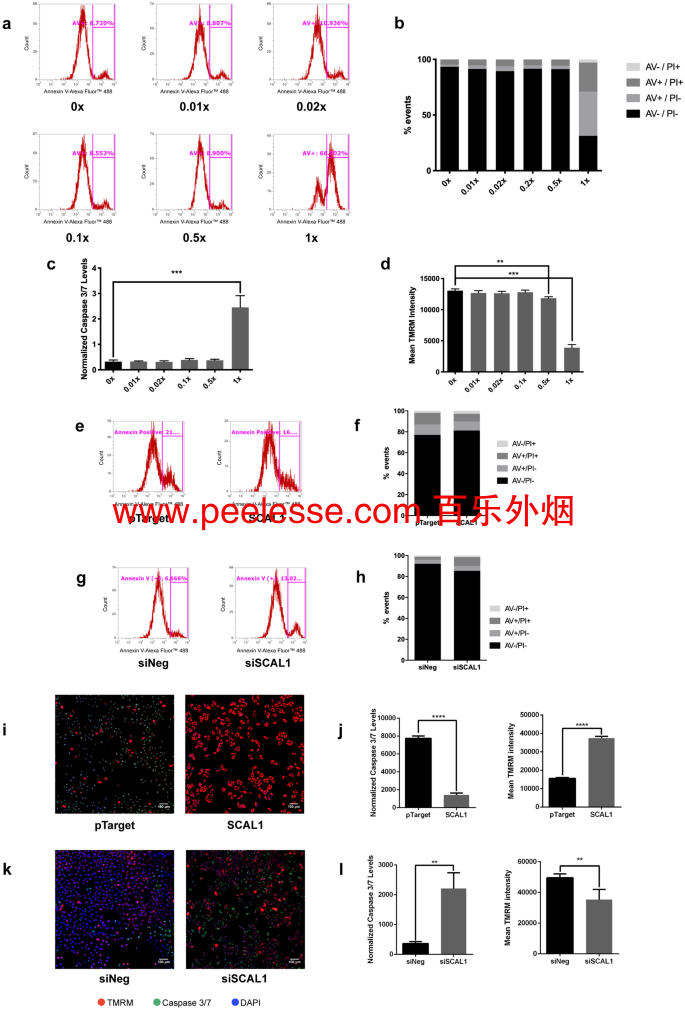
使用膜联蛋白 V/碘化丙啶 (AV/PI) 流式细胞术分析评估细胞凋亡抗性。用 0 至 0.5 倍的 CSE 浓度处理 A549 细胞,然后通过添加甲萘醌亚硫酸氢钠 (MSB) 诱导细胞凋亡不会导致细胞凋亡,如高比例的 AV-/PI- 和低数量的 AV+细胞群中的细胞(图4a,b),表明烟雾暴露表现出最小甚至没有毒性。然而,在浓缩的CSE设置,在人群中显著移观察到,具有31.27%AV- / PI-细胞,和66.80%AV +细胞(图4的a,b)。

CSE 处理和 SCAL1 表达使 A549 细胞能够抵抗 MSB 的凋亡诱导。(a)除了用1×CSE处理的细胞外,代表凋亡细胞的膜联蛋白V-Alexa Fluor 488门控事件不受CSE处理的影响。(b)活细胞群(AV-/PI-)在不同的 CSE 处理中保持不变,除了 1x CSE 设置表现出向更多凋亡 (AV+) 细胞的转变。(c)低 caspase 3/7 水平在不同的 CSE 处理中持续存在,但在 1× CSE 设置中增加。(d)用TMRM强度测量的线粒体完整性不受与较低水平CSE孵育的影响,但在用1×CSE处理的细胞中大大降低。( e) 膜联蛋白 V-Alexa Fluor 488 门控事件在 SCAL1 过表达后减少。(f)在 SCAL1 上调时,活细胞群(AV-/PI-)的增加伴随着凋亡细胞(AV+)数量的减少。(g)膜联蛋白 V-Alexa Fluor 488 门控事件在 SCAL1 敲低后增加。( h ) SCAL1 敲低导致活细胞群 (AV-/PI-) 减少和更多数量的凋亡 (AV+) 细胞。(i,j)半胱天冬酶 3/7 和活性线粒体的荧光染色显示 SCAL1 过表达细胞中的半胱天冬酶 3/7 水平较低,TMRM 强度较高。( k 。 l) SCAL1 敲低导致更高的半胱天冬酶 3/7 染色强度和更低的 TMRM 水平。提供的数据代表一式三份进行的三项独立试验,并表示为平均值 ± SD。*P < 0.05,**P < 0.01,***P < 0.001 和 ****P < 0.0001。
全尺寸图片高数凋亡细胞可以归因于在胱天蛋白酶的观察增加3/7(图 4 c)中加上激活降低线粒体功能(图 4中暴露于最高浓度CSE细胞d)。在CSE-处理的A549,其中SCAL1过表达,通常通过保持低胱天蛋白酶3/7活性和防腐剂的线粒体完整性(图显示出凋亡诱导性细胞4 C,d)。因此,即使存在强诱导剂,CSE 诱导的 SCAL1 上调也可能赋予对细胞凋亡的抗性。
为了进一步探索 SCAL1 上调的推定抗细胞凋亡作用,在使用各种 CSE 浓度的细胞凋亡测定的背景下进行了 SCAL1 过表达和敲低。在过表达A549减少SCAL1 AV +细胞的百分比从21.52到16.75%(图4 E,F),而SCAL1敲低提高这些凋亡细胞两倍以上从6.09到13.57%(图4 G,H)。这是一致的与观察到的下降时SCAL1(图的过表达胱天蛋白酶3/7活性和更完整的线粒体在A549细胞中4 I,J)。相反,SCAL1 敲低导致更高的半胱天冬酶 3/7 水平和更低的线粒体完整性(图4 k,l)。
SCAL1 解毒 ROS 种类的细胞
为了确定 SCAL1 是否在解毒细胞和减少 ROS 种类方面发挥作用,将 A549 细胞用 0.1×CSE 处理 24 小时以上调 SCAL1 表达。然后用 30 nM siSCAL1 转染细胞(图5a,b),以查看 lncRNA 水平的降低是否使细胞更容易受到氧化应激的影响。使用可渗透细胞的 DCFDA(2'。7'-二氯荧光素二乙酸酯)荧光染料评估细胞内 ROS 水平。CSE 处理的 A549 细胞的 DCFDA 染色显示 SCAL1 敲低后 ROS 水平增加,表明当 SCAL1 下调时,细胞变得更容易受到氧化应激的影响。
DCFDA 对 CSE 处理的、SCAL1 缺陷的和 SCAL1 过表达的 A549 细胞进行染色,以评估活性氧的产生(Olympus IX51,×100,FITC:500 毫秒)。( a 。 b ) 基于荧光素的染料 DCFDA 在被 ROS 氧化后呈现绿色荧光。在 A549 细胞中观察到的亮绿色信号表示 ROS 的产生。针对细胞计数标准化的 DCFDA 强度显示在 SCAL1 敲低后平均 ROS 产生增加。( c 。 d)DCFDA 荧光信号在 SCAL1 过表达设置中较低,表明增加的 SCAL1 水平会降低 ROS 的产生。提供的数据代表一式三份进行的三项独立试验,并表示为平均值 ± SD。*P < 0.05,**P < 0.01,***P < 0.001 和 ****P < 0.0001。
全尺寸图片相反,用P目标-SCAL1构建体转染的A549细胞相比,仅载体控制(图得到下DCFDA荧光水平5 ℃,d)。这表明 SCAL1 上调因此导致细胞内 ROS 产生减少,从而导致 A549 肺癌细胞的解毒。
这些结果也证实了 NRF2 介导的抗氧化基因上调的假定作用,例如 SCAL1 继发于香烟烟雾暴露,可保护细胞免受氧化应激带来的损伤。
讨论
人们普遍承认,由于氧化损伤的遗传病变和形成DNA加合物,在部分的采集,驱动香烟烟雾相关肺肿瘤发生32,33,34。然而,尽管有这些无休止的遗传损伤,细胞存活并保持活力的机制仍不清楚。NRF2的作用的阐明,以及它如何激活抗氧化基因35,36作为促存活机制阐明细胞如何保持存活,尽管不是没有功能性结果的损伤的一些光。最近,lncRNAs 被提议在解毒过程中发挥作用,作为对异物侮辱的反应。
在分析暴露于烟雾的肺癌细胞中的整体 RNA 表达后,Thai 等人。13发现了一种新的 lncRNA 转录本(烟雾和癌症相关的 lncRNA 1 或 SCAL1),其表现出异常高的表达水平。他们还显示吸烟者与非吸烟者气道上皮中 SCAL1 水平显着升高,一项研究高达 5.3 倍,另一项研究高达 3.9 倍。本研究旨在使用 A549 腺癌肺泡上皮细胞作为模型系统,在 SCAL1 控制的细胞活力和增殖之外的致癌表型方面进一步表征 SCAL1。与其他 lncRNA 一样,鉴于 lncRNA 功能的高背景特异性,本文所述的观察和结果是否可以外推到其他细胞背景,甚至在肺组织内,还有待观察。
CSE 及其随之而来的 SCAL1 上调被证明可以促进细胞迁移。SCAL1 对 CSE 的反应表现出剂量依赖性,直到特定阈值,超过该阈值 SCAL1 回到基线水平(图 1a),很可能是通过激活有效抑制其表达的负反馈机制。这种趋势也反映在暴露于不同浓度的CSE的细胞的迁移能力如示于图2的a,b。过度解毒可能降低了应激分子与 KEAP1 的氧化亲电结合,导致其稳定,并使其再次结合 NRF2 并促进其蛋白水解降解。这反过来可能会关闭 SCAL1 的新生转录,而较旧的 SCAL1 转录本变得不稳定。
迁移能力的增强以及观察到的广泛的细胞骨架重塑可能有助于解释烟雾相关肺癌的高转移率,因为细胞配备了分子逃逸机制,允许它们离开原发肿瘤部位以建立新的肿瘤其他地方的殖民地。检查了 CSE 治疗、SCAL1 过表达和 SCAL1 敲低对细胞骨架组织的影响,以发现与观察到的 A549 肺癌细胞迁移能力增加的相关性。癌细胞通过形成诸如片状伪足和丝状伪足等基质降解结构来获得运动性和侵袭性。虽然片状伪足是细胞运动的主要结构,37,38。在暴露于 CSE 和 SCAL1 上调的细胞中检测到这些富含肌动蛋白的结构,以及它们在 SCAL1 缺陷细胞中的缺失表明这种 lncRNA 增强了 A549 细胞的迁移能力。
用 CSE 和外源性 SCAL1 过表达进行治疗会产生与迁移和侵袭能力相关的重叠和不同的瞬时结构,这表明在某些情况下,它们的影响可以解耦。在 CSE 处理的 A549 肺癌细胞中,隧道纳米管的形成更加明显和广泛。这些丝状延伸正在积极研究中,因为它们在直接细胞间通讯和与肿瘤侵袭和转移有关的细胞货物的传输中发挥作用39. 除了打开离散的通信途径外,TNT 还允许形成开放式通道,介导膜连续性,以平衡由病理变化和波动条件(如氧化应激或营养缺乏)引起的应激因素。因此,通过 TNT 进行的细胞间转移让位于显着影响主要生理过程的分子途径的发生,例如细胞存活、氧化还原或通过 ROS 解毒和线粒体异质性的代谢稳态40 。 41. 在暴露于 CSE 的细胞中形成 TNT 样结构可能是应对吸烟引起的氧化应激的一种适应机制。在 CSE 处理的细胞中观察到的其他瞬态结构包括与细胞运动相关的厚外周肌动蛋白边缘。它们通常是形成片状伪足的积极指标。这些肌动蛋白边缘也可能在细胞迁移28期间核的变形性和延展性中发挥作用。
另一方面,在没有 CSE 暴露的情况下,SCAL1 过表达揭示了瞬态结构,这些结构也能够导致细胞骨架解体以促进或促进细胞迁移。外周褶皱、CDR、核周肌动蛋白边缘以及位于外周和拉伸的核是突出的。还观察到大的多核细胞。外周褶皱和片状伪足与癌细胞的间充质迁移有关,并且可以引发粘附相互作用和细胞外基质 (ECM) 重塑42。外周褶皱最终通过向内折叠而成为 CDR,这样做能够破坏和软化细胞骨架,从而实现迁移43。众所周知,CDR 在支持肿瘤生长的微胞饮作用中发挥作用44 . 核周肌动蛋白边缘、外周核位移和核拉伸或变形能力的存在都支持细胞骨架重塑,为迁移和入侵做准备45。核周肌动蛋白边缘的瞬时组装,特别是,应该保护基因组的完整性,直到细胞内稳态重新建立46。在没有 CSE 暴露的情况下,SCAL1 对细胞骨架重塑的不同表型影响表明 SCAL1 上调可能仅部分介导 CSE 暴露的致癌作用。CSE 处理和 SCAL1 过表达都能够促进迁移能力。
在已知上调 SCAL1 表达的 CSE 浓度中,A549 细胞显示出即使在强诱导剂存在下也能抵抗细胞凋亡。pTargeT-SCAL1 构建体的过表达本身产生了类似的效果。另一方面,SCAL1 敲低导致更高的 caspase 3/7 水平和更低的线粒体完整性。总之,这些表明 SCAL1 上调,继发于香烟烟雾暴露或通过替代机制,确实保护细胞并促进存活。
还通过观察细胞内应激诱导分子(如 ROS)的水平来研究对氧化应激的反应。由于高细胞内 ROS 水平导致的 DNA 氧化损伤已被证明会促进致癌突变47。然而,肿瘤细胞也可能上调抗氧化蛋白及其解毒调节剂,以防止诱导 ROS 介导的细胞凋亡并确保细胞存活。这在细胞凋亡试验中得到证实,其中过度表达 SCAL1 的暴露于香烟烟雾的细胞显示出对诱导细胞死亡的抵抗力。
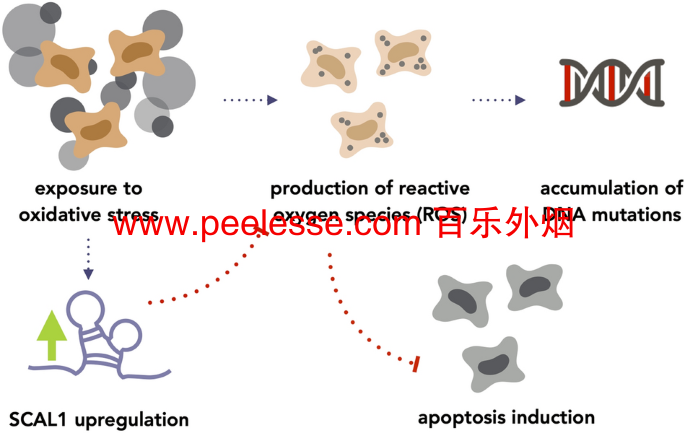
呼吸道上皮细胞的香烟烟雾暴露已被证明会增加 ROS 水平48 。 49. 在这项研究中,SCAL1 的敲低和过表达被用来为早期的建议提供证据,即 SCAL1 上调可能促进细胞解毒,以确保它们的活力和存活。事实上,在用 0.1×CSE 预处理的 A549 细胞中敲低 SCAL1 以诱导 SCAL1 上调导致 ROS 水平相应增加。相反,pTargeT-SCAL1 的过度表达产生了相反的效果。总之,这些表明 SCAL1 表达的增加可能导致细胞内 ROS 的减少和随之而来的 ROS 介导的细胞凋亡的抑制。然而,这也意味着已经积累了可能有害和致癌的 DNA 突变的细胞可以免于程序性细胞死亡,从而可以进一步繁殖。在这种情况下, 6)。

SCAL1 上调的假定途径以解释 CSE 暴露后 ROS 的减少。SCAL1 可能响应氧化应激而上调以抑制 ROS 的产生,这可能有效地抑制细胞凋亡的诱导。
全尺寸图片已经确定慢性而非急性香烟烟雾暴露会诱发致癌作用。然而,急性暴露后的体外实验,例如本研究中描述的那些,具有指导意义,因为它们显示了细胞致癌表型是如何被促进的,并且在持续暴露于香烟烟雾时可能变得不可逆,并且允许 DNA 和细胞损伤被覆盖修复机制。SCAL1 是从有吸烟史的肺癌患者的失调转录物分析中发现的,这一事实表明长期接触香烟烟雾可以维持或稳定体内 SCAL1 的表达。
本研究中描述的结果表明 SCAL1 在吸烟的情况下具有保护作用,但需要注意的是,DNA 受损的细胞也可以存活和繁殖。SCAL1 的致癌作用也可以与香烟烟雾的致癌作用分离,这表明该 lncRNA 可能通过其他机制上调以促进致癌性。无论哪种方式,它作为诊断和预后生物标志物的潜力已经在考虑之中。孙等人。50在他们涉及 68 名患者的研究中,表明 SCAL1 水平升高与更大的肿瘤大小以及晚期肿瘤淋巴结转移 (TNM) 阶段之间存在统计学上显着的关联。此外,他们表明 SCAL1 表达增加与预后不良和总体生存率降低有关。靶向 SCAL1 也可能是一种可行的治疗选择。通过允许抗增殖、抗迁移和细胞死亡信号抑制肿瘤生长、转移扩散和抗凋亡,SCAL1 敲低可能使癌细胞对靶向治疗敏感。
材料和方法
A549 细胞在维持培养基和 CSE 注入培养基中的培养
Adenocarcinomic肺泡上皮细胞(A549; ATCC;马纳萨斯,VA,USA)中培养,并保持在T-25培养瓶中用Dulbecco改进的Eagle培养基(DMEM; Gibco公司®,赛默飞世尔科技公司,沃尔瑟姆,MA,USA)和10% 胎牛血清 (FBS; Gibco ® ) [DMEM + 10%FBS] 在受控环境条件下 (37 °C。 5% CO 2)。通过将香烟棒连接到含有 10 ml DMEM + 10% FBS 的 50 ml 无菌注射器的喷嘴来配制含有 CSE 的改良培养基。香烟棒点燃后,通过反复推拉柱塞抽吸主流烟气。消耗棒后,将注射器内的介质剧烈摇晃 20 秒,以确保最大程度地溶解烟雾。将该过程重复5次,然后将所得培养基通过0.22μmMinisart灭菌®滤波器并被指定为浓CSE-DMEM(1支香烟棒:10毫升DMEM + 10%FBS)。
将 A549 细胞接种在测定板上并孵育约 24 小时以使其附着在底物上。随后,将培养基更换为不同稀释度的CSE-DMEM[浓缩CSE(1×)、两倍稀释(0.5×)、十倍稀释(0.1×)、50倍稀释(0.02×)和100倍稀释( 0.01×)],而一口井用维持培养基补充作为对照。在进行下游功能测定和分析之前,将 A549 细胞再培养 48 小时。
RNA提取
RNEasy Plus Mini Kit(Qiagen Sciences。 Inc.。 Germantown。 MD。 USA)用于从 A549 中提取总 RNA,A549 以每孔 150。000 个细胞的密度接种在 12 孔板上。使用 Nanodrop 2000c 分光光度计(Thermo Fisher Scientific)通过分光光度法(λmax = 260 nm)测定 RNA 浓度,并将样品储存在 - 80 °C 直至进一步使用。
通过 RT-qPCR 检测 SCAL1 表达水平
根据制造商推荐的方案,使用 PowerUp™ SYBR Green Real-Time PCR (Thermo Fisher Scientific) 试剂盒进行 RT-qPCR。使用M-MLV逆转录酶的200 U(Promega公司®,麦迪逊,WI,USA),2000纳克的RNA反转录成cDNA。将含有寡聚 dT、随机六聚体和 RNA 样品的退火反应混合物在 70°C 下孵育 5 分钟。然后将 M-MLV 逆转录酶缓冲液加入混合物中至最终浓度为 1x。此外,25 U 的 RNase 抑制剂(Promega ®)、0.075 mM 的脱氧核苷三磷酸 (dNTPs) 和 200 U 的 M-MLV 逆转录酶包含在反应混合物中,最终体积为 25 µl。通过在 37°C 下长达一小时的孵育促进了逆转录过程,并将所得 cDNA 储存在 - 20°C 直至使用。
比较了暴露于不同滴度 CSE-DMEM 的 A549 细胞中的 SCAL1 转录水平。为了确定急性暴露于 CSE 后恢复对 SCAL1 表达的影响,A549 细胞用 0.1×CSE-DMEM 处理 48 小时,然后在不含 CSE 的 DMEM 中培养 24 小时。表1显示了用于扩增 SCAL1 转录物和亲环蛋白基因作为标准化对照的引物。
SCAL1 lncRNA 基因表达构建体的生成
SCAL1 基因块获自 Integrated DNA Technologies(Coralville,IA,USA)(参考编号 98409609)。该转录本通过非定向 TA 克隆被克隆到 pGEM ® -T Easy 克隆载体 (Promega ® ) 中。如下在连接前添加 A-突出端:首先将含有 1× Titanium Taq 缓冲液、5× Titanium Taq 聚合酶(Clontech Laboratories。 Inc.。 Mountain View。 CA。 USA)和 1 mM dNTPs 的试管在 95°下孵育C 5 分钟,然后加入 24.5 ng 基因块,所得混合物在 72°C 下孵育 15 分钟。从带有聚 A 附加 SCAL1 块的溶液中,将 1.1 µl 添加到 2×T4 DNA 连接酶缓冲液(Roche ® Diagnostic,GmbH,德国曼海姆)、50 ng pGEM ®的单独混合物中-T Easy 克隆载体 (Promega ® ) 和 0.25 U T4 DNA 连接酶缓冲液 (Roche ® )。然后将 5.2 µl 溶液按照以下曲线进行孵育:4 °C 2 小时、22 °C 4 小时和 14 °C 过夜,然后将其用于转化为 DH5α 超感受态大肠杆菌细胞。具有经验证序列的重组 pGEM ® -T Easy-SCAL1 构建体用 EcoRI 消化,亚克隆到 pTargeT™ 哺乳动物表达载体中,并通过测序验证准确性和方向性。
A549 细胞中 SCAL1 的敲除
在 12 孔板中,每孔接种约 300。000 个 A549 细胞,并用 30 nM AllStars(Qiagen Sciences。 Inc.。 Germantown。 MD。 USA)阴性对照 siRNA(si-NEG,目录号 1027280)转染或 30 nM SCAL1-siRNA(Hs_LOC100505994_3;Qiagen FlexiTube siRNA SI05713505)。使用的阴性对照是非沉默对照 siRNA,与任何哺乳动物基因都没有已知的同源性。转染通用 siRNA 对照解释了转染的压力,并被用作确定基因表达的正常基础水平的基础。
在所有设置中,使用 Lipofectamine™ 3000 转染试剂 (Invitrogen) 用适量的 siRNA 转染 A549 细胞。RNA-Lipofectamine™ 复合物制备如下:每次转染反应,使用 Opti-MEM 将 30 nM siRNA 稀释至 50 µl 终体积。在另一管中,将 3 µl Lipofectamine™ 3000 转染试剂用 Opti-MEM 稀释至 50 µl。然后将 RNA 和 Lipofectamine™ 溶液混合并在室温下孵育 10-15 分钟以允许发生复合,然后将所得 100 µl 溶液加入贴壁 A549 细胞中。转染后 48 小时,收集细胞用于随后的分子、形态和功能表征实验。如前所述,通过 RT-qPCR 评估 SCAL1 敲低的效率。
将 pTargeT™-SCAL1 构建体转染到 A549 细胞中
将 150。000 个 A549 细胞接种到 12 孔板中 24 小时后,使用在敲低研究中用于 SCAL1-siRNA 脂质转染的相同方法转染 1000 ng 构建体。在不同的孔中,分别转染 1000 ng 空 pTargeT™ 载体和空 pmR-ZsGreen1 载体作为阴性对照和转染效率跟踪器。
对于每个设置,使用 Bio-Rad TC20™ 自动细胞计数仪(Bio-Rad Laboratories。 Inc.。 Hercules。 CA。 USA)确定细胞计数,从中计算出每次测定接种的适当细胞数。所有测定(至少三项试验)均使用一式三份接种的样品进行,以确保获得的结果的可重复性。
划伤试验
在划痕试验中,每孔约 20。000 个 A549 细胞接种在 96 孔透明底黑板 (Corning) 中,含有 DMEM + 10% FBS 维持培养基。细胞在 37 °C 和 5% CO 2下孵育。 以允许细胞附着。为了促进伤口闭合率的量化,细胞用荧光染料钙黄绿素染色。简而言之,将钙黄绿素 AM 以 2 µg/ml 的终浓度添加到低血清培养基 (DMEM + 2% FBS) 中。然后使用无菌牙签沿直线划伤孔以在汇合细胞单层中形成伤口。用 1×D-PBS 清洗孔,随后使用 GE IN Cell Analyzer 6000 高内涵成像系统(GE Healthcare Life Sciences;Marlborough,Massachusetts,USA)成像。16 小时后再次对细胞进行钙黄绿素染色,然后成像。伤口闭合率用 GE IN Cell Analyzer 6000 分析软件测量。
监测细胞骨架结构的变化
通过用异硫氰酸荧光素 (FITC) 共轭鬼笔环肽(5 µg/ml;Life Technologies。 Thermo Fisher Scientific。 Inc.。 Waltham。 MA。 USA)染色肌动蛋白丝并用 Hoechst 33342(5 µg/ml ;生命科技)。A549 细胞接种在 96 孔透明底黑板 (Corning) 上(5000 个细胞)。接种后 24 小时,细胞用 CSE 处理或用 siRNA 或过表达质粒转染。48小时后,去除培养基,用1×PBS洗涤孔,然后加入4%多聚甲醛,室温固定样品1小时。然后用冰冷的 PBS 洗涤细胞 3 次,每次 5 分钟,然后加入 0.1% Triton™ X-100(Sigma-Aldrich,St. Louis,MO,USA)在室温下透化细胞 10 分钟. 随后是封闭步骤,其中包括添加 1% BSA 并在室温下持续搅拌 (60 rpm) 孵育 1 小时。用冰冷的 1× PBS 洗涤细胞后,加入 FITC 偶联的鬼笔环肽,并将样品与荧光细胞骨架染料一起在室温下在黑暗中持续搅拌(60 rpm)孵育 30 分钟。细胞再次用冰冷的 1× PBS 洗涤,然后加入核染色剂 Hoechst 33342,随后在室温下避光孵育 15 分钟。在用冰冷的 1× PBS 进行最后的洗涤步骤后,使用 GE IN Cell Analyzer 6000 高内涵成像仪和 Olympus IX3-HOS 显微镜(Olympus Corp.,Tokyo,Japan)使用绿色荧光滤光片获得荧光图像( λex/λem:490/525 nm) 以可视化染色的丝状肌动蛋白结构,
用 DCFDA 染色活性氧
通过用 2'。7'-二氯荧光素二乙酸酯 (DCFDA; Sigma-Aldrich。 St. Louis。 MO。 USA) 染色进行细胞内活性氧 (ROS) 水平的可视化和测量。DCFDA 染色的重新接种是通过将 8000 个 A549 细胞每孔放置在 96 孔透明底黑板 (Corning) 上来完成的。对于 SCAL1 敲低,细胞用 0.1×CSE 处理 24 小时以诱导 SCAL1 上调,随后用 30 nM siSCAL1 转染以减少细胞内 SCAL1。对于 SCAL1 过表达,细胞用 pTargeT-SCAL1 转染并孵育 24 小时,然后用 0.1×CSE 处理。siSCAL1 或 pTarget-SCAL1 转染 48 小时后,将 DCFDA 染色剂 (50 µM) 添加到每个孔中。
膜联蛋白 V/碘化丙啶流式细胞术分析
在康宁平底聚苯乙烯 12 孔板中,接种了 150。000 个细胞并使其附着。通过与 100 µM 甲萘醌亚硫酸氢钠 (Sigma-Aldrich) 在还原血清培养基 (DMEM + 4% FBS) 中孵育 12 小时来诱导细胞凋亡。收集所有悬浮和贴壁细胞,然后根据制造商的说明使用 Alexa Fluor 488 Annexin V/Dead Cell Apoptosis Kit (Thermo Fisher Scientific) 观察凋亡细胞。
Caspase 3/7 水平和线粒体完整性的测量
A549 细胞接种在康宁平底聚苯乙烯 96 孔板(5000 个细胞)中。随后,接种后 24 小时,通过在还原血清培养基 (DMEM + 4% FBS) 中与 100 µM 甲萘醌亚硫酸氢钠 (Sigma-Aldrich) 孵育 12 小时来诱导细胞凋亡。Caspase 3/7 活性和线粒体活性通过与 2 µM CellEvent™ Caspase-3/7 Green Detection Reagent (Thermo Fisher Scientific) 和 2 µM Image-iT™ TMRM Reagent (Thermo Fisher Scientific) 孵育 30 分钟来检测。使用 GE IN Cell Analyzer 6000 高内涵成像仪 (Caspase-3/7 λex/λem:503/530 nm; TMRM λex/λem:548/574 nm) 获得荧光图像。使用 IN Cell Developer Toolbox v1.6 (GE Healthcare) 进行荧光信号的量化。
统计分析
为了量化控制和各种实验设置之间的差异,使用了未配对的双尾学生 t 检验。各个图中的量化表示为平均值 ± 标准偏差 (SD)。P < 0.05 用于定义统计显着性。







